

日前,美國癌癥研究協會(AACR)發布了2022年抗癌進展報告(AACR Cancer Progress Report 2022)。AACR成立于1907年,是全球成立最早,規模最大的致力于全面、創新和高水平癌癥研究的科學組織之一。這一報告著重介紹了從2021年8月到2022年7月底,美國FDA總計批準了8款創新抗癌療法,以及10款獲批擴展治療癌癥類型的抗癌療法。
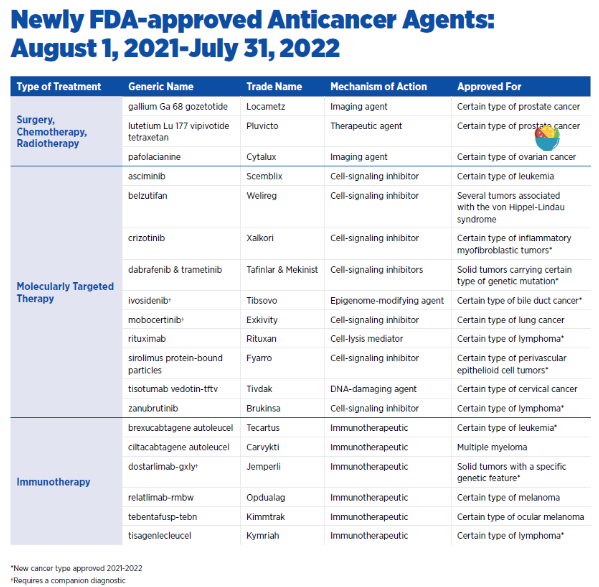
其中,靶向療法可以更為精準地針對腫瘤中的癌細胞,從而讓治療更為有效,并且降低對健康組織的毒性。而且,這些靶向療法,為治療罕見癌癥提供了有力的手段。罕見癌癥雖然發病率不高,但是種類繁多,根據美國國家癌癥研究所(NCI)的統計,美國的癌癥死亡病例中四分之一由于罕見癌癥。
例如,2021年8月獲得FDA批準的Welireg(belzutifan)是一款缺氧誘導因子抑制劑,它獲得批準用于治療von Hippel-Lindau(VHL)疾病相關癌癥。VHL是一種罕見遺傳疾病,它可異常激活癌癥患者體內的缺氧誘導因子(HIF-2α)。HIF-2α因子從而在患者體內蓄積并導致良性和惡性腫瘤的形成。
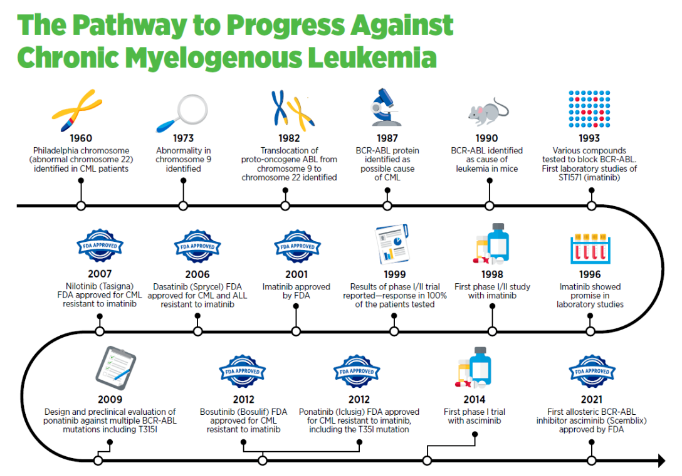
在治療血液癌癥方面,2021年10月,FDA批準的Scemblix(asciminib)是首款靶向ABL1靶點的肉豆蔻酰口袋的別構抑制劑。為治療攜帶BCR-ABL突變的慢性髓系白血病(CML)患者提供了有力的治療選擇。對CML的治療也體現了靶向療法開發的進展,2001年首款靶向療法格列衛的獲批,是40多年來科學家們多個科學突破的結晶。
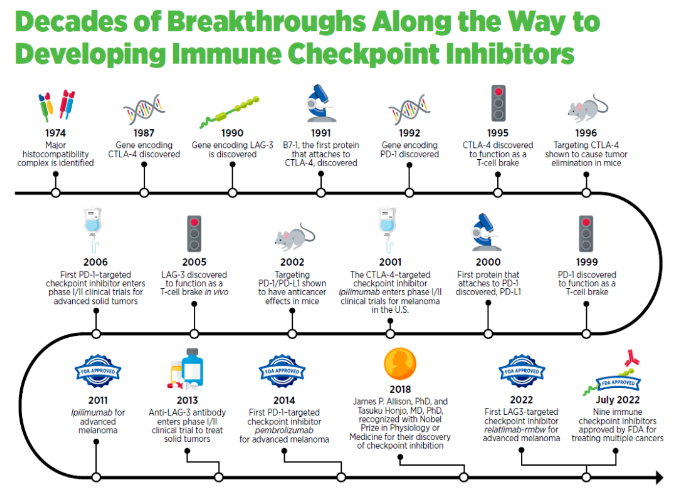
在免疫療法方面,截至2022年7月,已經有9款免疫檢查點抑制劑獲得FDA的批準,治療多種癌癥類型。在2022年,首個靶向LAG-3的免疫檢查點抑制劑relatlimab獲得FDA的批準,這也是近10年來針對全新免疫檢查點蛋白獲批的首款創新免疫療法。
AACR的報告尤其指出了在癌癥早期階段使用免疫檢查點抑制劑的潛力。比如,在某些早期肺癌患者中,PD-1抗體nivolumab與化療在手術切除前聯合使用,與化療和安慰劑構成的對照組相比,將切除組織中沒有癌癥跡象的患者比例提高了11倍。
在一項小型2期臨床試驗中,12名錯配修復功能缺陷(dMMR)的局部晚期直腸癌患者在接受PD-1抗體dostarlimab治療后獲得完全緩解,并且在未接受手術切除或后續化放療的情況下,維持無癌狀態可達超過2年。
值得一提的是,并不是所有患者都能從免疫檢查點抑制劑中獲益,因此科學家們仍在繼續開發創新免疫療法,用其它方法激發免疫細胞的抗癌反應。比如,今年初獲批的Kimmtrak(tebentafusp)是首款獲批的T細胞受體(TCR)療法。它是一種雙特異性融合蛋白,能夠模擬TCR的功能,識別腫瘤表面的gp100抗原,并且通過與T細胞表面的CD3受體結合,激活T細胞的抗癌反應。
CAR-T療法通過對人體的T細胞進行改造,將它們變成識別并殺傷腫瘤的細胞療法。截至2022年7月,美國FDA已經批準了6款CAR-T療法,其中在2021年獲批的Abecma和2022年獲批的Carvykti是獲得批準治療多發性骨髓瘤的CAR-T療法。
報告表示,未來的抗癌進展需要在國家和國際范圍內的合作。跨學科合作推動的科學和技術創新有望對患者護理帶來革命性的變化。有望進一步推動癌癥科學研究的新技術包括:
CRISPR-Cas9系統:這一革命性的基因編輯手段不但可以幫助研究人員精準修改基因組,研究對細胞功能產生的影響,而且在改造細胞療法方面具有廣闊的前景。
靶向蛋白降解療法:這類療法可以幫助研究人員將與疾病相關的蛋白降解,在癌癥領域,它可以用于靶向傳統小分子藥物難于靶向的靶點,比如p53,STAT3,RAS,MYC等蛋白。
空間轉錄組學(spatial transcriptomics):這一技術可以在單細胞的水平對組織樣本的基因表達圖譜進行分析,從而詳細描繪出腫瘤的異質性。它可以用于預測腫瘤的進化,以及發現腫瘤與其它細胞的復雜互動關系。
去卷積表型篩選:這一策略讓研究人員基于對整個生物通路變化的綜合性評估,而不是單一靶點來發現和設計新抗癌療法。
單分子成像技術:這一技術可以幫助在癌癥早期在患者體液中發現單個生物標志物蛋白,從而更早發現癌癥。


全國共有49家實驗室報名參加,其中45家提交有效結果,僅23家通過評價活動,通過率為51.1%。

由中國臨床腫瘤學會(CSCO)主辦的"2020年中國臨床腫瘤學年度進展研討會"近日于線上順利召開,會上專家學者們對2020CSCO消化道腫瘤指南更新做了總結,近幾年頗受關注的免疫治療在新版指南中地位突顯,地位相較于舊版指南有所提升。
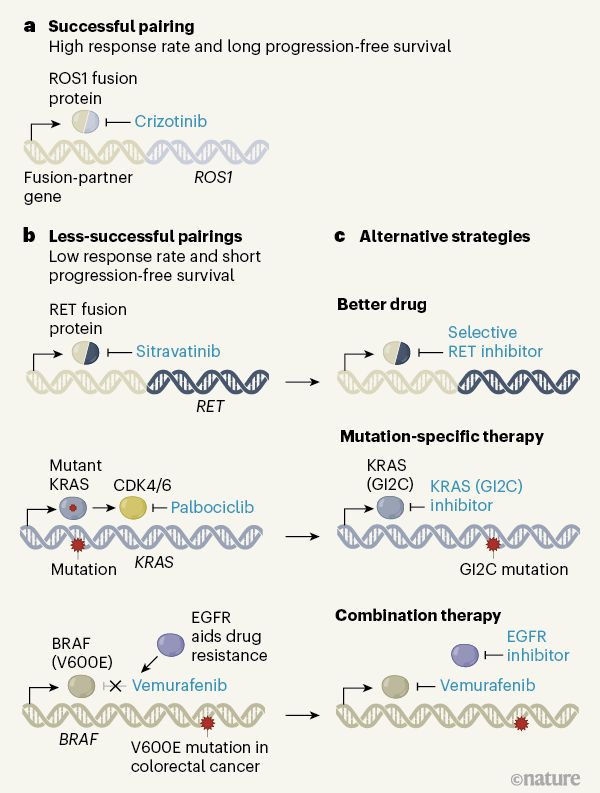
由伯明翰大學癌癥研究中心英國臨床試驗小組領導的一項開拓性的肺癌研究強調了下一波精準醫學研究,特別是治療基因組復雜癌癥需要考慮的重要因素。