

作為癌癥治療的“第四極”,以免疫檢查點抑制劑(ICIs)為代表的免疫治療仍然發展迅猛,不僅在適應證上繼續開疆拓土,藥物種類也不斷豐富,尤其是首個LAG-3抑制劑在2022年獲批,將與PD-1/L1抑制劑和CTLA-4抑制劑并肩作戰。
但不可否認的是,免疫治療距離發展中“啃硬骨頭”的階段也越來越近,許多棘手的難題都在制約其臨床療效,例如胰腺癌等免疫“冷腫瘤”久攻不下,而T細胞耗竭等因素,也使許多患者難以實現持久病情控制和長生存。
那么免疫治療破局的關鍵點在哪里?有人把目光投向了癌癥中比比皆是的表觀遺傳改變,如果能明確影響抗腫瘤免疫應答的表觀遺傳機制和通路,就能設法增援正處于苦戰之中的免疫治療,找到全新的藥物乃至聯合治療方案。
近期在Clinical Cancer Research期刊上,耶魯大學醫學院嚴欽(Qin Yan)教授等三位專家就共同撰文,討論了表觀遺傳對癌細胞-T細胞相互作用的影響,尤其是如何借此增強癌細胞免疫原性、預防T細胞耗竭,從而破解制約免疫治療效果的兩大關鍵枷鎖,一起來看這篇專家銳評吧!
表觀遺傳對癌細胞免疫原性的調節
部分實體瘤之所以會成為對ICIs治療缺乏應答的“冷腫瘤”,主要是腫瘤中的癌細胞免疫原性較低、新抗原較少,而學界對此提出的破解策略,就包括通過表觀遺傳調節,使正常情況下被靜默的基因組非編碼區,如長末端重復序列(LTR)、長/短散在核元件等恢復表達,從而讓癌細胞免疫原性增強,為ICIs創造戰機。
2015年先后發表在《細胞》的兩項研究顯示,使用阿扎胞苷抑制DNA甲基化,可誘導屬于LTR的內源性反轉錄病毒(ERV)表達和轉錄上調,進而激活抗病毒相關的干擾素信號通路,也就是“模擬病毒感染”來增敏卵巢癌和結直腸癌細胞,使ICIs更好地抑制腫瘤。
此外有研究顯示,H3K4去甲基化酶LSD1或KDM5B的表達缺失,也會通過解除ERV的表達沉默,激活干擾素信號通路,增強T細胞對腫瘤的浸潤和PD-1抑制劑的療效;組蛋白甲基轉移酶SETDB1也可以通過相似機制,參與癌細胞免疫逃逸的調節,且存在于多種癌癥中;類似的靶標還有SUV39H1、G9A、EZH2等等。
表觀遺傳如何調節T細胞耗竭
表觀遺傳對T細胞的發育、分化、激活、細胞因子釋放及免疫記憶都有重要影響,而且還能參與調節PD-1等免疫檢查點的表達,因此特定的表觀遺傳標志物,已被證明可用于預測免疫治療的療效和患者預后。而表觀遺傳對T細胞耗竭的調節,可能對現有免疫療法的影響更加深遠。
目前認為,T細胞耗竭的特征為產生IL-2、IFN-γ和TNF-α的能力下降,且清除抗原的能力減弱。除終末耗竭的CD8+T細胞亞群外,近年來研究又發現了耗竭性的CD8+T細胞祖細胞,這部分具有自我更新能力的T細胞,同樣對免疫治療非常重要,這兩類耗竭T細胞的轉錄組學及細胞表面標志物研究已相當深入。
但表觀遺傳調節耗竭的相關機制仍未充分闡明。從現有研究來看,表觀遺傳調節的影響可能主要在ICIs治療之后:ICIs往往可以短暫地重編程或激活T細胞,使其恢復效應細胞樣的轉錄和功能表型,但在DNA甲基化和組蛋白修飾的影響下,T細胞染色質狀態仍大體維持穩定,這會使ICIs的作用迅速消失,T細胞重回耗竭狀態,這種調節機制也被稱為“表觀遺傳傷痕”(Epigenetic Scarring)。
在多項臨床前研究中,DNA甲基轉移酶抑制劑(DNMTs)與ICIs或細胞免疫療法聯合使用,均通過逆轉T細胞耗竭實現了協同增效,但廣譜抑制DNA甲基化也可能損害正常T細胞的免疫功能,因此需要更加精準高效的靶向治療藥物。上文提到的去甲基化酶LSD1,也被發現可能與T細胞的耗竭有關。
2021年發表在《科學》的一項研究則發現,表觀遺傳改變參與了CAR-T細胞因持續激活導致的耗竭,在通過抑制關鍵信號通路使CAR-T細胞短暫“休息”時,多種耗竭相關基因的表觀遺傳狀態發生了明顯改變,而這一過程也是組蛋白賴氨酸甲基轉移酶EZH2依賴性的,提示了表觀遺傳的影響。
總而言之,對于終末耗竭CD8+T細胞亞群的表觀遺傳改變,現有ICIs治療還是“無能為力”的,而針對關鍵位點的表觀遺傳治療,有望重新激活CD8+T細胞,使其響應免疫治療,但目前的表觀遺傳治療還難以做到僅精準靶向T細胞,系統性的副作用不容低估,這也是未來藥物研發必須破解的難關。
總結
制約現有ICIs療效的兩大難題,主要是免疫冷腫瘤和治療耐藥,而表觀遺傳都會通過種種調節作用參與其中,尤其是近年來發現的表觀遺傳對癌細胞本身免疫原性、對T細胞耗竭狀態的調節,這都是影響ICIs療效的關鍵問題,而且表觀遺傳還會對其它類型的免疫療法,例如CAR-T療法的療效產生影響。
目前已有多種表觀遺傳藥物獲FDA批準,用于急性髓細胞白血病等瘤種的治療,表觀遺傳藥物聯合ICIs的大量臨床研究也在進行之中,隨著未來更加精準,即高選擇性、高親和力、酶特異性的新型表觀遺傳藥物問世,表觀遺傳+免疫治療有望開啟癌癥免疫治療的下一個關鍵篇章。


全國共有49家實驗室報名參加,其中45家提交有效結果,僅23家通過評價活動,通過率為51.1%。

由中國臨床腫瘤學會(CSCO)主辦的"2020年中國臨床腫瘤學年度進展研討會"近日于線上順利召開,會上專家學者們對2020CSCO消化道腫瘤指南更新做了總結,近幾年頗受關注的免疫治療在新版指南中地位突顯,地位相較于舊版指南有所提升。
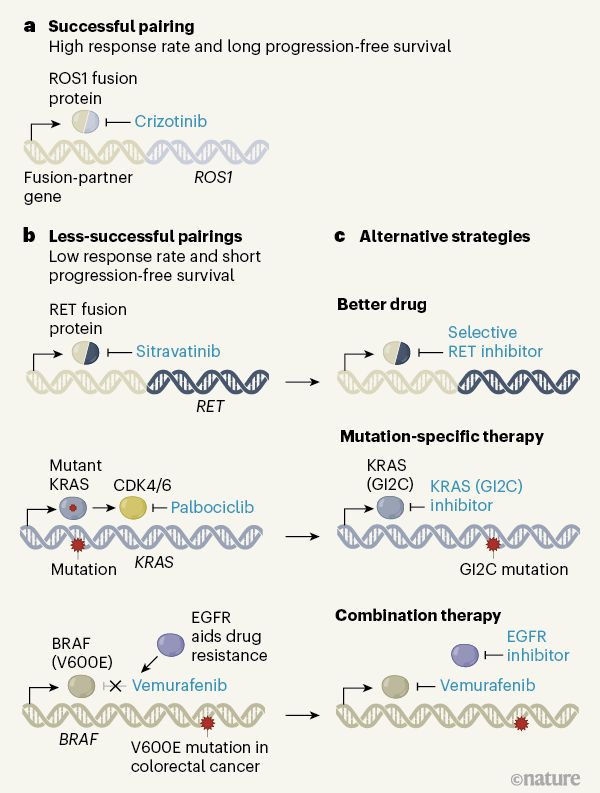
由伯明翰大學癌癥研究中心英國臨床試驗小組領導的一項開拓性的肺癌研究強調了下一波精準醫學研究,特別是治療基因組復雜癌癥需要考慮的重要因素。